随着科技水平和医疗水平的发展,人类的寿命大大提高,但同时也加剧衰老相关并发症的发生。
以往研究发现衰老是肥胖、胰岛素抵抗、Ⅱ型糖尿病、血脂异常、肝脂肪变性等代谢相关疾病的重要危险因素。此外,这些代谢异常情况也会反过来损害人体健康,并最终影响寿命。然而,连接代谢失调和衰老的机制细节目前仍然知之甚少。
脂肪组织是能量储存的主要场所,保持其完整性对能量稳态和代谢健康至关重要,但是其在衰老中总是受到干扰。目前,衰老过程中脂肪组织的病理重塑仍然是一个谜。
2024年2月19日,北京大学基础医学院的强力教授研究团队与汪丽恒教授团队合作在Cell Metabolism 杂志上发表了题为“IgG is an aging factor that drives adipose tissue fibrosis and metabolic decline”的研究论文。
该研究报道IgG在衰老过程中积累,特别是在白色脂肪组织(WAT)中,损害脂肪组织功能和代谢健康。热量限制(CR)减少了WAT中IgG的积累,而补充IgG抵消了CR的代谢益处。
IgG通过Ras信号激活巨噬细胞,从而通过TGF-β/SMAD途径诱导WAT纤维化。一致地,B细胞缺失小鼠可以避免衰老相关的WAT纤维化、炎症和胰岛素抵抗,除非暴露于IgG。巨噬细胞中IgG循环受体新生儿Fc受体(FcRn)的条件消融可阻止IgG在衰老过程中的积累,从而延长健康寿命和寿命。此外,通过反义寡核苷酸靶向FcRn可恢复老年小鼠WAT的完整性和代谢健康。这些发现指出IgG是衰老的一个隐藏的罪魁祸首,并启发了一种新的策略来恢复代谢健康。

科学技术的进步大大延长了人类的寿命,但同时也加剧了与衰老有关的并发症。衰老是肥胖、胰岛素抵抗、2型糖尿病、血脂异常、肝脂肪变性等的重要危险因素。这些代谢状况反过来会严重损害人体健康,并最终影响寿命。多种信号通路已经与衰老的分子特征联系在一起:胰岛素/胰岛素样生长因子-1 (IGF-1)/叉状盒O转录因子(FoxO;DAF-16(秀丽隐杆线虫中的DAF-16),哺乳动物雷帕霉素靶蛋白(mTOR), Sirtuins和腺苷5 '单磷酸活化蛋白激酶(AMPK)。这些经典的长寿途径都对代谢调节至关重要,这意味着衰老的代谢基础。然而,连接代谢失调和衰老的机制细节仍然知之甚少。
脂肪组织是能量储存的主要场所,保持其完整性对能量稳态和代谢健康至关重要-这一过程经常在衰老中受到干扰。事实上,脂肪组织是为数不多的器官之一,其中器官限制干预足以影响寿命和健康寿命。大多数啮齿类动物的长寿干预措施与脂肪组织功能的改变有关:例如热量限制(CR)、雷帕霉素治疗、手术切除内脏脂肪和消除衰老细胞。与其他主要代谢器官相比,与年龄相关的转录组学变化在脂肪组织中发生得更早,且幅度更大,这意味着脂肪组织可能至少驱动了衰老过程中一部分代谢紊乱。随着年龄的增长,脂肪组织出现表型特征,包括脂肪细胞肥大、慢性炎症、纤维化、胰岛素抵抗和脂肪生成受损,所有这些都与代谢功能障碍密切相关。然而,脂肪组织在衰老过程中的病理重塑仍然是一个谜,需要一个驱动因素,可能是多重标志的基础。
抗体,以免疫球蛋白(Igs)的形式,是对病原体的适应性免疫防御的卓越效应器。在5种主要抗体中,免疫球蛋白G (IgG)占全部血清抗体的80%左右。IgG由抗原结合片段(Fab)和Fc片段组成。在典型的适应性免疫应答中,B细胞在抗原存在下被激活,并通过Fab产生特异性抗体来中和抗原,同时与先天免疫细胞上的Fcγ受体(FcγRs)相互作用,触发抗体依赖性细胞毒性,并通过内体内化破坏含有抗原的病原体。与IgA或IgM不同,IgG具有特别长的半衰期,因为它具有独特的再循环机制。
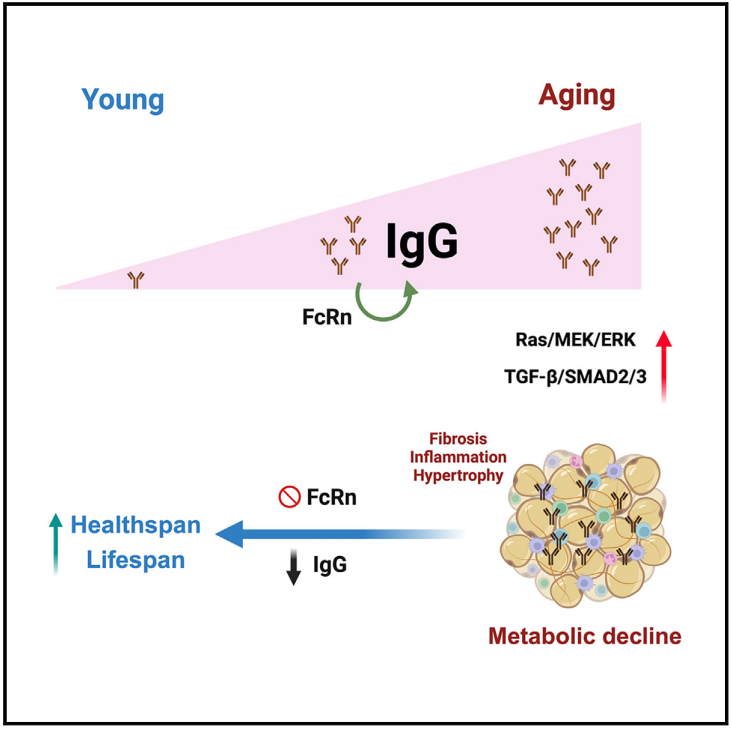
文章模式图(图源自Cell Metabolism )
IgG在与其受体(FcγRs)结合后内化到核内体中。随着核内体在成熟过程中酸化,IgG从FcγRs转移到新生Fc受体(FcRn),这是唯一的IgG循环受体。然后FcRn循环并在中性pH下将IgG释放出质膜,而未结合的IgG则被分类用于溶酶体降解。除了经典的免疫功能外,IgG在代谢中的作用尚未得到重视。值得注意的是,IgG主要被认为是一种血浆蛋白,它在衰老背景下的组织存在、调节和功能(如果有的话)是未知的。
该研究深入探索了衰老过程中脂肪组织的致病性重塑,以了解随年龄增长的代谢下降。该研究意外地在白色脂肪组织(WAT)中发现了显著的年龄相关的IgG积累。通过体外和补充体内模型,该研究证明IgG是衰老过程中脂肪组织变性和代谢下降的驱动因素,因此是延长健康寿命的新兴治疗靶点。
参考消息:https://doi.org/10.1016/j.cmet.2024.01.015













